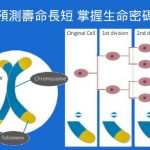
巴黎2024年1月25日 /美通社/ -- 全球昆蟲蛋白頂尖製造商 Ÿnsect 獲得 AAFCO(美國飼料控制官員協會)的授權,可在犬用營養品中使用脫脂麵包蟲蛋白。這是美國首次批准在寵物食品使用麵包蟲作為原料。 這一授權經過為期兩年的評估,由負責美國動物食品安全監管機構...
Author - [email protected]
香港2024年1月25日 /美通社/ -- 歷來規模最大、展位最多,由展覽集團舉辦的「香港寵物節2024」今日起至1月28日(四至日)一連四日假...
本研究發表於核酸療法領域前沿同行評審期刊《核酸研究癌症》 香港、馬里蘭州德國城和中國蘇州2024年1月24日 /美通社/ -- Sirnaomics Ltd...
杭州和紹興2024年1月24日 /美通社/ -- 歌禮製藥有限公司(香港聯交所代碼:1672,「歌禮」)今日宣佈ASC40(地尼法司他)治療中、重度尋常性痤瘡的III期臨床試驗於復旦大學附屬華山醫院完成首例患者給藥。...
口服伊諾格魯肽(Oral Ecnoglutide)安全性、耐受性良好,最常見的不良事件為胃腸道反應 受試者接受每日一次30 mg口服伊諾格魯肽(Oral Ecnoglutide)治療,持續6周,平均體重相對基線降低6.8%,而安慰劑組降低0.9%...
新北市2024年1月23日 /美通社/ -- 康霈生技( 6919-TW )新藥 CBL-514 用於新藥查驗登記申請( NDA )之多國多中心非手術局部減脂臨床三期樞紐試驗 ( Pivotal CBL-0301 Phase 3 Study )申請已取得澳洲主管機關 Bellberry HREC...
中國北京、美國麻省劍橋和瑞士巴塞爾2024年1月23日 /美通社/ -- 百濟神州(納斯達克代碼: BGNE;香港聯交所代碼:06160;上交所代碼:688235)是一家全球生物科技公司,今日宣佈任命Olivier...
PreveCol® 是一種用於腫瘤診斷的血液檢測,已在美國獲得認可。與美國現有替代方案相比,其在檢測癌前病變方面的功效更佳。 Amadix 成為首家宣佈在結腸直腸癌的早期檢測方面獲得此認可的歐洲公司。 馬德里2024年1月23日 /美通社/ ...
在一項針對168例纖維化2期或3期NASH患者進行的52周臨床試驗中,地尼法司他在主要終點和多個次要終點均取得了統計學顯著性差異的結果 - 主要療效終點:...
香港2024年1月23日 /美通社/ -- 根據香港聯交所1月22日披露的文件,科倫博泰母公司科倫藥業於1月22日以每股90港元場外大宗交易增持$科倫博泰生物-B(06990.HK)78.5萬股H股股份,價值約7000萬港元。 關於科倫博泰生物 四川科倫博泰生物醫藥股份有限公司(6990...